Zdjęcie w tle: ESA
Choroba Alzheimera jest poważnym problemem współczesnego świata i, mimo że została odkryta ponad 100 lat temu, dalej jest chorobą nieuleczalną, nieustannie zbierającą swoje żniwo. Szacuje się, że do 2050 roku dotknie ona jedną na 85 osób. Aby odnaleźć sposób na zwalczenie tej choroby, musimy dokładnie poznać mechanizmy jej działania. Z pomocą przychodzą nam badania przeprowadzane na ISS.
Mechanizm powstawania choroby Alzheimera
Choroba Alzheimera jest wywoływana przez zniekształcone białka, które niszczą strukturę mózgu. Odpowiedzialne są za to dwa rodzaje białek – białka amyloidowe oraz białka tau, zbijające się w większe struktury nazywane blaszkami starczymi oraz splątkami neurofibrylowymi. Blaszki starcze powstają, gdy jeden z enzymów odpowiedzialnych za rozkład białka zwanego APP, występującego w lipidowej błonie otaczającej komórki nerwowe (najczęściej α-sekretaza) – jest zastąpiony β-sekretazą. Rozkład APP przy pomocy β-sekretazy zamiast α-sekretazy powoduje oddzielenie się białka zwanego β-amyloidem, ze względu na zmianę miejsca przecięcia wiązania. β-amyloidy są związkami wyjątkowo chętnymi do łączenia się w większe fragmenty – oligomery, które mogą zakłócać przewodzenie impulsów nerwowych, gromadząc się wokół synaps. Mogą one tworzyć jeszcze większe struktury – blaszki amyloidowe, które nie są rozpuszczalne w wodzie, a także nie mogą być po prostu usunięte z ludzkiego organizmu. Zaburzają one komunikację między komórkami i zakłócają sygnały nerwowe. Mikroglej, komórka wyspecjalizowana do obrony immunologicznej organizmu, na działanie β-amyloidów może odpowiedzieć wyrzutem cytokin (które potencjalne mogą uszkodzić inne komórki nerwowe) oraz pochłanianiem synaps.
Drugą strukturą odpowiedzialną za zmiany w mózgu są białka tau. W normalnych warunkach są one składnikiem mikrotubuli, maleńkich rurek odpowiedzialnych za przekazywanie substancji odżywczych między komórkami. Białka tau pozwalają zachować prawidłową strukturę oraz funkcjonowanie mikrotubuli. W wyniku zmian w organizmie może dojść do fosforylacji tych białek, które zaczynają tworzyć splątki neurofibrylowe. Są to struktury podobne do blaszek starczych, z tą różnicą, że występują wewnątrz, a nie na zewnątrz, komórki. Powstawanie owych splątków sprawia, że mikrotubule nie mogą utrzymać swojej struktury, wiec nie mogą prawidłowo funkcjonować. Skutkuje to brakiem substancji odżywczych dostarczanych do neuronów i dochodzi do apoptozy – zaprogramowanej śmierci komórki.
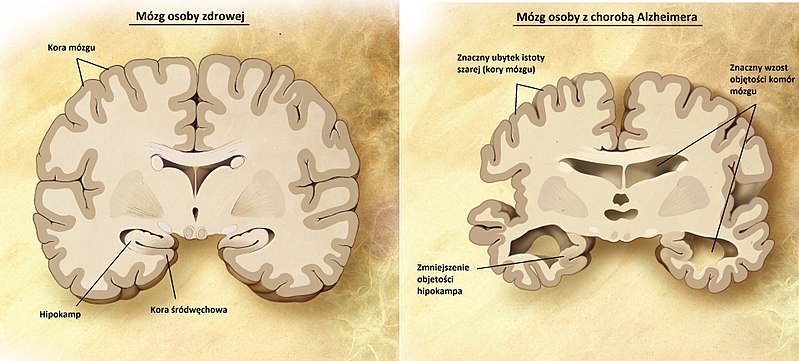
Porównanie mózgu osoby zdrowej (po lewej) i osoby z chorobą Alzheimera (po prawej).
Zabójcze działanie blaszek starczych oraz splątków neurofibrylowych rozpoczyna się w hipokampie – obszarze mózgu odpowiedzialnym za powstawanie wspomnień oraz pamięć krótkotrwałą (dlatego pierwszym symptomem choroby Alzheimera jest utrata pamięci krótkotrwałej). Chorzy często nie pamiętają co jedli na śniadanie, czy są zdezorientowani, co może prowadzić do gubienia się. W miarę rozprzestrzeniania się dewastujących białek w mózgu pacjent traci umiejętność logicznego myślenia i nie jest w stanie kontrolować swoich emocji, co objawia się częstymi wahaniami nastroju. W kolejnych fazach występują halucynacje i paranoja. Blaszki i splątki niszczą też wspomnienia zawarte w pamięci długotrwałej. Na koniec, mogą one zająć obszar mózgu odpowiedzialny za podstawowe funkcje życiowe – odbierają możliwość samodzielnego oddychania czy bicia serca, co prowadzi do śmierci.
Jak dotąd, nie poznaliśmy ani pełnego mechanizmu powstawania blaszek i splątek, ani nie odkryliśmy leku, który pozwoliłby wygrać z chorobą. Najczęstszą obecnie stosowaną farmakoterapią jest podawanie leków mających na celu zwiększenie ilości acetylocholiny, która jest odpowiedzialna za przekazywanie sygnałów między neuronami. Nadzieją mogą być badania na Międzynarodowej Stacji Kosmicznej.
Jak badania na ISS mogą pomóc nam w badaniach nad chorobami neurodegeneracyjnymi?
Projekt Japońskiej Agencji Eksploracji Aerokosmicznej JAXA miał za zadanie zbadanie powstawanie białek odpowiedzialnych za choroby neurodegeneracyjne, a dokładniej β-amyloidów. Cztery próbki zostały przetransportowane i przechowywane na ISS w temperaturze -95°C, a następnie ogrzane do temperatury 2°C, aby przygotować je do inkubacji. Każda próbka była inkubowana w module CBEF (Cell Biology Experiment Facility) w temp. 37°C przez 6 godzin, 1, 3 lub 9 dni. Po zakończeniu eksperymentu próbki przetransportowano w temperaturze -95°C na Ziemię i zbadano w laboratoriach.
Astronauta Norishige Kanai w module „Kibo”.
Po raz pierwszy odkryto różnice w formowaniu się oraz morfologii włókien amyloidowych hodowanych na Ziemi i w warunkach mikrograwitacji. W kosmosie włókna białek formowały się znacznie wolniej, a same struktury białek były bardziej skręcone w porównaniu z próbkami kontrolnymi. Podobna tendencja występowała także w procesach krystalizacji białek. Co to dla nas znaczy? Otrzymaliśmy wyjątkową możliwość poznania mechanizmu formowania się białek amyloidowych bez czynnika, którego nie potrafimy w normalnych warunkach kontrolować – grawitacji. Dzięki temu możemy dokładniej zrozumieć, jaki wpływ na powstawanie tych szkodliwych włókien wywiera środowisko.
Zdjęcie moduł CBEF na Międzynarodowej Stacji Kosmicznej.
Jak dotąd, nie poznaliśmy mechanizmów powstawania białek odpowiedzialnych za choroby neurodegeneracyjne i tak naprawdę nie wiele wiemy o samych schorzeniach. Poznanie procesu odpowiedzialnego za tworzenie się białek β‑amyloidowych, a w szczególności jego wczesnych etapów – zarodkowania i formowanie oligomerów, może pomóc nam w znalezieniu skutecznego leku, którym moglibyśmy wyleczyć chorych nie tylko na chorobę Alzheimera, ale też chorobę Parkinsona czy cukrzycę.